Thông tin khoa học
Điều trị thoái hóa khớp gối bằng cách sử dụng tế bào gốc mỡ tự thân (ADSC) và huyết tương giàu tiểu cầu (PRP): một nghiên cứu lâm sàng
Điều trị thoái hóa khớp gối bằng cách sử dụng tế bào gốc mỡ tự thân và huyết tương giàu tiểu cầu: một nghiên cứu lâm sàng
Khanh Hong-Thien Bui1, Triet Dinh Duong1, Nhan Thanh Nguyen1, Thanh Duc Nguyen1, Vien Tuong Le1, Viet Thanh Mai1, Nhan Lu-Chinh Phan2, Dung Minh Le2, Ngoc Kim Ngoc2, Phuc Van Pham 2,*
1Bệnh viện Đại học y dược Tp. HCM, Thành phố Hồ Chí Minh, Việt Nam
2 PTN nghiên cứu và ứng dụng tế bào gốc, Trường Đại học Khoa học, Đại học Quốc gia Việt Nam, thành phố Hồ Chí Minh, Việt Nam; * Tác giả:pvphuc@hcmuns.edu.vn
Received: 15 December 2013 / Accepted: 02 February 2014 / Published online: 7 February 2014 © The Author(s) 2014. This article is published with open access by BioMedPress (BMP), Laboratory of Stem Cell Research and Application.
TÓM TẮT
Thoái hóa khớp gối là một trong những bệnh phổ biến nhất, và nó ảnh hưởng đến 12 % dân số trên thế giới. Mặc dù căn bệnh này là bệnh mãn tính, nó làm giảm đáng kể chất lượng cuộc sống của bệnh nhân. Hiện nay, liệu pháp tế bào gốc được coi là một cách tiếp cận hiệu quả để điều trị tình trạng này.Tế bào gốc trung mô (MSC) cho thấy tiềm năng nhất cho liệu pháp tế bào gốc điều trị thoái hóa khớp gối. Trong thực tế, MSC có thể phân biệt các mô mesodermal nhất định như sụn và xương. Vì vậy, trong nghiên cứu này, chúng tôi áp dụng MSC có nguồn gốc từ mỡ để điều trị thoái hóa khớp gối. Nghiên cứu này nhằm đánh giá hiệu quả lâm sàng của các mô mỡ tự thân có nguồn gốc MSC cấy ghép ở những bệnh nhân thoái hóa khớp gối độ II và III. Mô mỡ được phân lập từ bụng, và được sử dụng để tách chiết các phân đoạn nhỏ của mạch máu (SVF) . Các SVF được trộn với huyết tương giàu tiểu cầu đã hoạt hóa trước khi tiêm. Hiệu quả lâm sàng được đánh giá bằng điểm đau (VAS), điểm số Lysholm, và MRI. Chúng tôi thực hiện trong 21 trường hợp từ năm 2012-2013. Tất cả 21 bệnh nhân cho thấy cải thiện chức năng khớp sau 8.5 tháng. Điểm số đau giảm từ 7.6 ± 0,5 trước khi tiêm xuống còn 3.5 ± 0,7 sau 3 tháng và 1.5 ± 0.5 sau 6 tháng sau khi tiêm. Điểm số Lysholm tăng từ 61 ± 11 trước khi tiêm lên 82 ± 8.1 sau khi tiêm. Tiến triển đáng kể này đã được ghi nhận trong chụp MRI, với độ dày của lớp sụn tăng.
Hơn nữa, không có tác dụng phụ hoặc biến chứng liên quan đến nhiễm trùng, thải ghép, hoặc tác nhân gây ung thư mới. Những kết quả này cung cấp một cơ hội mới cho việc điều trị thoái hóa khớp gối. Mức chứng cứ : IV.
Keywords-Osteoarthritis, Adipose tissue-derived stem cell, Stromal vascular fraction, Platelet rich plasma.
GIỚI THIỆU
Tổn thương sụn là một tình trạng lâm sàng thường gặp, đặc biệt là ở những người độ tuổi trên 40. Tổn thương như vậy có thể dẫn đến viêm xương khớp nếu không được điều trị thích hợp. Viêm xương khớp là một sự tiến triển thoái hóa mãn tính mà kết quả là thoái hóa sụn khớp, thoái hóa khớp, thay đổi cấu trúc của xương, và mất chức năng khớp (Wieland et al., 2005). Tại thời điểm hiện tại, tổn thương sụn được điều trị bằng thuốc (Dougados năm 2001;. Eyigor et al, 2006) hoặc tiêm axit hyaluronic (Chen et al, 2011;.. Karatosun et al, 2008;. Spakova et al, 2012) để giảm triệu chứng, giảm đau, và kiểm soát vôi hóa. Tuy nhiên, những phương pháp điều trị bị hạn chế về hiệu quả và không ngăn chặn được quá trình tiến triển của bệnh (Schroeppel et al., 2011).
Nuôi cấy sụn cũng được sử dụng để điều trị tổn thương sụn từ năm 1994. Sụn tự thân được tách triết và nuôi cấy trước khi tiêm vào khớp. Nuôi cấy sụn đã cung cấp một số kết quả tốt (Frisbie và cộng sự, 2008;. Kreuz và cộng sự năm 2013,;. Lee et al, 2003.). Tuy nhiên, phương pháp này cũng có một số hạn chế, đặc biệt là thiếu nguồn sụn nuôi cấy, hầu như tất cả các sụn đều bị chết sau một thời gian nuôi cấy trưởng thành.
Một nghiên cứu gần đây cho thấy sự hiện diện của tế bào gốc trong các mô mỡ, và được gọi là các tế bào gốc có nguồn gốc từ các tế bào mỡ (ADSCs). Những tế bào này được coi là tế bào gốc trung mô (MSC) có biểu hiện một số tính chất đặc biệt.
Chúng tham gia hình thành bề mặt giống như nguyên bào sợi, và biệt hóa thành các tế bào tạo xương, sụn, và các tế bào mỡ (Zuk et al. , 2001). Họ cũng thể hiện các dấu hiệu đặc biệt của MSC, chẳng hạn như CD44, CD73, CD90 và CD105, nhưng đều âm tính với CD14, CD34, CD45 (Gaiba et al, 2012; . . Khan và cộng sự, 2012;. Zhu et al, 2012; Zimmerlin và cộng sự, 2013). So với MSC từ tủy xương và máu dây rốn, ADSCs có nhiều lợi thế (Christodoulou et al. , 2013). Đặc biệt, ADSCs là một nguồn tế bào tự thân phù hợp. Cho đến nay, ADSCs đã trở thành ứng cử viên tuyệt vời cho nghiên cứu và ứng dụng lâm sàng. Nhiều nghiên cứu đã chỉ ra rằng cấy ghép ADSC có hiệu quả cải thiện hầu hết các triệu chứng của một số bệnh như xơ gan, dị tật thần kinh (Gu và cộng sự, 2012 ( Harn và cộng sự, 2012. ); . . Liu và cộng sự , 2011 ; Santiago et al, 2009), thiếu máu cục bộ (Mazo et al , 2012 ; . . . . . Rigol và cộng sự, 2010), chấn thương cơ xương (Pecanha và cộng sự, 2012), giảm tiểu cầu miễn dịch thụ động mãn tính (Xiao et al, 2012.), và nhồi máu cơ tim (Yang et al , 2012. ) ở động vật, và xơ cứng mô ở người ( Riordan và cộng sự năm 2009, ; . Scuderi et al , 2013.) .
Với tiềm năng to lớn của ADSCs, nhiều nghiên cứu đã được tiến hành trong vài năm gần đây, bao gồm cả thử nghiệm tiền lâm sàng và thử nghiệm lâm sàng để thực hiện điều trị chấn thương sụn và thoái hóa khớp. Một số mô hình động vật được sử dụng là những chú chó (Black và cộng sự, 2008;.. Black và cộng sự, 2007;. Guercio và cộng sự, 2012) ( Toghraie et al, 2011), trên thỏ, và trên ngựa (Frisbie và cộng sự, 2009) , chuột (Lee và Im, 2012), trên chuột (Ter Huurne và cộng sự năm 2012,;.. Văn Phạm và cộng sự, 2013b), và trên Dê (Murphy et al, 2003.).
Trong một nghiên cứu khác, ngược lại ADSCs được coi là ức chế sụn tái sinh. Kết luận này được rút ra từ thí nghiệm của ADSC ghép ở chuột. Nghiên cứu cho thấy ADSCs highly expressed và tiết ra VEGF-A trên bề mặt môi trường nuôi cấy. Phần nổi đã được tìm thấy để ức chế sự tăng sinh sụn, giảm Sox9, Alcan, và collagen II mức độ mRNA, giảm tổng hợp proteoglycan và tăng quá trình apoptosis. Kiểm tra mô học cho thấy các khuyết tật với ADSCs không mọc vào mô từ các cạnh của khuyết tật (Lee et al., 2012).
Trong các nghiên cứu công bố trước đây, chúng tôi đánh giá invitro trên mô hình động vật (chuột) tác dụng của huyết tương giàu tiểu cầu (PRP) trên ADSC biệt hóa thành tế bào sụn. Invitro, chúng tôi cho thấy điều trị bằng ADSCs kết hợp với PRP thúc đẩy sự phát triển và có sự khác biệt vào các tế bào chondrogenic (Van Pham et al., 2013a). Các tế bào thể hiện collagen II, Sox9, và aggrecan. Kết quả là, ADSCs PRP-pretreated cải thiện điều trị của sụn khớp bị chấn thương trong một mô hình chuột so với không điều trị ADSCs. Trong một nghiên cứu khác, chúng tôi nghiên cứu những tác động của PRP trên SVF ghép trong một mô hình chấn thương sụn chuột, và quan sát thấy sự tái sinh tuyệt vời của sụn (Van Pham et al., 2013b). Hơn nữa, không có tác dụng bất lợi từ ADSC hoặc ghép SVF được ghi lại trong các mô hình động vật (Van Pham et al., 2013a).
Dựa trên những kết quả này, chúng tôi thực hiện thử nghiệm lâm sàng này với mục đích đánh giá hiệu quả và tác dụng phụ của non-expanded SVF kết hợp với PRP trong thoái hóa khớp độ II và III.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Tiêu chí chọn lựa bệnh nhân
Tất cả bệnh nhân tham gia vào nghiên cứu này đều được yêu cầu kí cam kết thử nghiệm lâm sàng. Tất cả các phương pháp được sử dụng trong nghiên cứu này đều được phê duyệt bởi Ban Đạo đức và y tế thuộc Bệnh viện Đại học Y dược Tp Hồ Chí Minh (TP HCM , Vietnam).
Đối với tiêu chí chọn lụa, tất cả bệnh nhân ở độ tuổi trên 18, bị thoái hóa khớp sau trấn thương sụn cấp 2, 3; đã thất bại trong điều trị bằng thuốc cũng như ghép tế bào sụn tự thân, điểm Lysholm thấp hơn 65, đã cam kết với điều kiện phẫu thuật của bệnh viện, âm tính với HIV.
Tổng cộng có 21 bệnh nhân được đưa vào nghiên cứu. Nghiên cứu được thiết kế với phân loại endpoint về tính an toàn và hiệu quả, mô hình can thiệp là phân nhóm duy nhất không có kiểm soát, và mục đích chính là điều trị.
Tách chiết SVF từ mô mỡ
SVF đã được phân lập từ mỡ bụng của mỗi bệnh nhân. Lấy khoảng 50-100 ml mỡ thu thập từ mỗi bệnh nhân được cho vào 2 syringes vô trùng 50 ml. Tất cả các quy trình và các thao tác đã được phê duyệt bởi Ban đạo đức Bệnh viện Đại học Y Dược Thành phố Hồ Chí Minh, Việt Nam. Các syringes được lưu trữ trong một hộp vô trùng và bảo quản ở nhiệt độ 2-8°C và ngay lập tức chuyển đến phòng thí nghiệm.
SVF đã được tách chiết bằng cách sử dụng Bộ kit tách chiết ADSC (GeneWorld Co,. Ltd, Thành phố Hồ Chí Minh, Việt Nam) theo hướng dẫn của nhà sản xuất. Bộ kit này đã được sự cấp phép của Bộ Y tế Việt Nam như là một thiết bị y tế. 50-100 ml mỡ nhanh chóng được chuyển vào trong ống Fancol 250 ml vô trùng, sử dụng một lần (Corning, Tewksbury, MA) và rửa hai lần với PBS vô trùng bằng cách ly tâm 400 × g trong 5 phút ở nhiệt độ phòng. Tiếp theo, các mô mỡ đã được phân hủy bằng cách sử dụng SuperExtract trong bộ kit chứa collagenase ở 37 ° C trong 30 phút trong khoảng thời gian 5 phút. ly tâm ở 800 × g trong 10 phút, và SVF được thu thập ở dạng hạt. Các hạt được rửa sạch hai lần với PBS để loại bỏ bất kỳ enzyme nào còn sót lại, và lơ lửng trong PBS để xác định số lượng tế bào bằng cách sử dụng máy đếm tế bào (NucleoCounter; Chemometec, Đan Mạch ) .
Chuẩn bị PRP hoạt hóa
PRP hoạt hóa được lấy từ máu ngoại vi của bệnh nhân tương tự như xử lí các mô mỡ bằng cách sử dụng bộ kít New-PRPPro Kit (GeneWorld) theo hướng dẫn của nhà sản xuất, thu 20 ml máu ngoại vi được vào ống chân không và ly tâm ở 800 × g trong 10 phút. Lấy phần huyết tương phía trên ống ly tâm và ly tâm lần 2 ở 1000 × g trong 5 phút để thu được các tiểu cầu dạng hạt. Hầu hết các plasma sau đó đã được loại bỏ, giữ lại 3 ml huyết tương cho quá trình tái lắng của tiểu cầu. Cuối cùng, PRP được hoạt hóa bằng cách sử dụng ống hoạt hóa có chứa 100µl 20% CaCl2.
Chuẩn bị các sản phẩm để cấy ghép
Sản phẩm tiêm là một hỗn hợp thu được của SVF và PRP hoạt hóa. PRP hoạt hóa được sử dụng để pha loãng SVF để có một liều thích hợp để tiêm.
Tiêm và theo dõi
Tất cả các bệnh nhân đã được kiểm tra và đánh giá theo tiêu chí thu nhận vào 2 tuần trước khi cấy ghép. Tất cả các bệnh nhân đã được đánh giá lại tại 1, 3, và 6 tháng sau khi cấy ghép. Các phép đo kết quả chính bao gồm chỉ số điểm Lysholm, thay đổi so với ban đầu về điểm số chất lượng cuộc sống , và số lượng các tác dụng phụ được báo cáo (sau 1, 3 và 6 tháng). Các kết quả thứ cấp đã thay đổi so với ban đầu trong X-quang khớp bị ảnh hưởng (số điểm MRI) (sau 6 tháng).
Tất cả các bệnh nhân đã được kiểm tra sau khi hút các mô mỡ và máu ngoại vi để có được SVF và PRP hoạt hóa. Bệnh nhân chờ trong phòng phẫu thuật trong khoảng 2 giờ trước khi nhận được hỗn hợp tiêm của SVF và PRP mà không cần phẫu thuật khớp.
KẾT QUẢ
Nghiên cứu này bắt đầu vào đầu năm 2012 và hoàn thành vào đầu năm 2013. Tất cả bệnh nhân được kiểm tra có thoái hóa khớp ở độ II đến độ III. Kết quả cho thấy những cải tiến đáng kể trong chức năng khớp sau khi 8.5 tháng. Số điểm đau (VAS Walking Index) thay đổi đáng kể và dần dần giảm từ 7.6 ± 0.5 trước khi tiêm còn 3.5 ± 0.7 sau 3 tháng và 1.5 ± 0.5 sau 6 tháng. Điểm số Lysholm cũng được cải thiện đáng kể và dần dần tăng từ 61 ± 11 trước khi tiêm đến 71 ± 13 sau 3 tháng và 82 ± 8.1 sau 6 tháng.
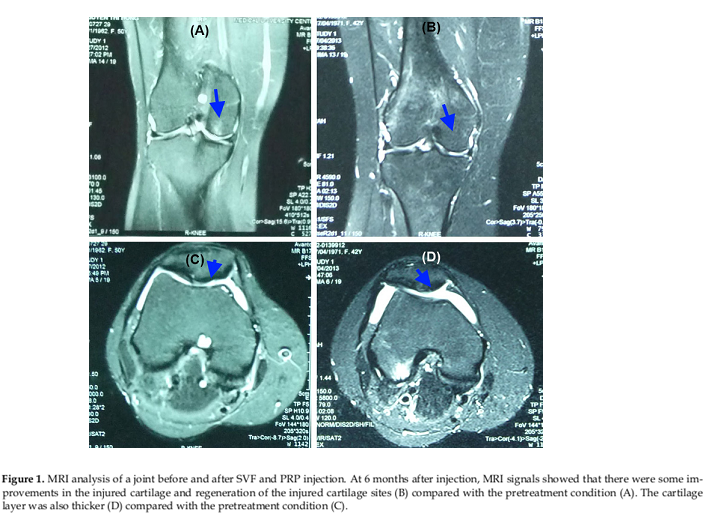
Về mô học, phân tích MRI cho thấy các lớp sụn được tái sinh một phần tại các điểm bị tổn thương. Những hình ảnh MRI cho thấy lớp sụn cũng dày hơn sau 6 tháng điều trị.
Nhìn chung, 100% bệnh nhân hài lòng với kết quả điều trị. Họ cảm thấy mức độ đau đớn của họ giảm dần, đặc biệt là sau 3 tháng. Có 15 bệnh nhân (71,24%) có thể đi lên xuống cầu thang sau 3 tháng. Hiện nay, 100% bệnh nhân có thể đi lại bình thường và thực hiện các hoạt động sống bình thường. Quan trọng hơn, 100% bệnh nhân không có tác dụng phụ hoặc biến chứng liên quan đến quy trình điều trị, chẳng hạn như nhiễm trùng hoặc các yếu tố Tumor khớp.
THẢO LUẬN
Thoái hóa khớp gối là bệnh chấn thương mãn tính phổ biến làm giảm đáng kể chất lượng cuộc sống của bệnh nhân. Trong những năm gần đây, việc ứng dụng ngăn chặn tế bào thoái hóa khớp đã phát triển nhanh hơn, với những kết quả đầy hứa hẹn trong các thử nghiệm tiền lâm sàng và lâm sàng. Nghiên cứu lâm sàng này cho thấy tiêm SVF và PRP mang lại một số kết quả tốt đối với bệnh nhân thoái hóa khớp.
Một trong những kết quả rõ ràng về tác dụng của việc tiêm SVF và PRP là các bệnh nhân cảm thấy giảm đau. Trong thực tế, số điểm VAS đã giảm đáng kể sau 6 tháng (từ 7.6 ± 0,5 đến 1.5 ± 0.5). Giảm đau có liên quan đến vai trò của PRP. Tại thời điểm hiện tại, PRP được sử dụng rộng rãi cho các điều kiện lâm sàng, đặc biệt là trong việc quản lý đau và viêm. PRP đã được báo cáo để ngăn chặn các NFΎB, bằng cách ngăn chặn sự cảm ứng của NFΎB từ IΎB, do đó chặn NFΎB trong tế bào chất và ngăn ngừa cảm ứng của gen mục tiêu NFΎB (van Buul et al., 2011). Trong một nghiên cứu trước đó, người ta thấy rằng NFΎB đã được kích hoạt bởi IL-1Ά trong sụn lấy từ bệnh nhân thoái hóa khớp. Ngay khi NFΎB được kích hoạt, gần như tất cả các con đường đồng hóa gen liên quan, chẳng hạn collagen II và tổng hợp aggrecan, bị chặn. Tuy nhiên, điều trị PRP có thể giải quyết được vấn đề này(van Buul et al, 2011;.. Wu et al, 2011).
Các tác dụng chống viêm và giảm đau cũng có liên quan đến các yếu tố tăng trưởng trong PRP. PRP chứa các cytokine, bao gồm HGF, PDGF, IGF, TGF-Ά, EGF, FGF và (Amable et al, 2013;. Banfi, 2012;. Hamilton et al, 2013). HGF đã được chứng minh hoạt động như một chất ức chế tăng trưởng của NFΎB (Bendinelli et al., 2010), giảm sản xuất các cytokine IL-6, và tăng cytokine chống viêm IL-10 (Coudriet et al., 2010). TGF-Ά1 loại CXCR4 trong bạch cầu đơn nhân (Bendinelli et al, 2010;.. Coudriet et al, 2010). IGF-1 và PDGF cũng ức chế sự hoạt hóa của NFΎB (Montaseri et al., 2011).
Các tác dụng chống viêm và giảm đau cũng đóng góp một phần từ các yếu tố hòa tan tiết ra từ SVF hoặc ADSCs. ADSCs tiết nhiều yếu tố hòa tan quan trọng như HGF, VEGF, NGF, EGF , FGF , và TGF- Ά (Kilroy et al, 2007; . . Salgado et al, 2010 ;. Van Pham et al, 2013a). Không giống như PRP, yếu tố tăng trưởng của ADSCs được sản xuất liên tục sau khi tiêm các tế bào này vào khớp. Tác động thứ hai của việc tiêm SVF và PRP là kích thích tăng trưởng sụn tại các điểm tiêm. Kết quả cho thấy các lớp sụn dần dần trở nên dày hơn từ 3 và 6 tháng sau khi tiêm, và một số điểm sụn bị thương đặc biệt được tái sinh. Những phát hiện này phát sinh từ tác động kết hợp ADSCs và PRP. Trong một số nghiên cứu trước đây của chúng tôi trên chuột, chúng tôi ghi nhận rằng SVF và PRP cũng như ADSC và PRP hoạt hóa hình thành các neocartilage (Van Pham và cộng sự, 2013a ; . . Văn Phạm và cộng sự, 2013b). Như ADSCs thể hiện VEGF- A, nó ức chế sự phát triển của sụn, nếu chỉ ghép ADSCs có thể ức chế sự tăng trưởng sụn (Lee et al. , 2012). Trong nghiên cứu này và một nghiên cứu trước đó trên chuột (Van Pham et al. , 2013a ), chúng tôi sử dụng ADSCs kết hợp với PRP hoạt hóa để ức chế sản xuất VEGF, qua đó cải thiện ADSC biệt hóa thành tế bào sụn.
Sự tồn tại của ADSCs được ghép tại các địa điểm tiêm cũng như sự tham gia của ADSCs trong hình thành neocartilage không được xác minh trong nghiên cứu này. Tuy nhiên, trong một nghiên cứu khác (dữ liệu không hiển thị), chúng tôi đánh dấu ADSCs của người với GFP và tiêm vào các khớp của những con chuột mô hình NOD / SCID. 30 ngày sau khi cấy ghép, các tế bào GFP-đánh dấu ở sụn đầu gối đã được thu thập và đánh giá các biểu hiện của gen nhất định liên quan đến sụn, như collagen loại II, aggrecan, và Sox9. Kết quả cho thấy các tế bào GFP-đánh dấu thể hiện rõ những gen này. Những phát hiện này cho thấy ADSCs trong môi trường khớp gối đã gây ra để biệt hóa thành tế bào sụn.
Các ảnh hưởng có lợi của việc cấy ghép ADSCs cũng đã được ghi nhận trong các thử nghiệm lâm sàng ở một số nước. Trong một nghiên cứu gần đây, Jo et al. (2014) thực hiện một nghiên cứu lâm sàng có liên quan đến điều trị thoái hóa khớp đầu gối bằng cách tiêm ADSCs với 18 bệnh nhân. Sau 6 tháng, bệnh nhân được tiêm 1 × 108 tế bào đã được cải thiện đáng kể điểm số WOMAC và kích thước của sụn khuyết tật, không có tác dụng phụ (Jo et al., 2014). Trong một nghiên cứu liên quan đến ít bệnh nhân hơn , Pak (2011) báo cáo rằng gần như tất cả các bệnh nhân cho thấy sự cải thiện đáng kể trong tất cả các kết quả lâm sàng tại khâu kiểm tra theo dõi cuối cùng. Tất cả các kết quả lâm sàng được cải thiện đáng kể 2 năm tiếp theo so với 12 tháng theo dõi (Pak, 2011).
KẾT LUẬN
Tóm lại, khả năng tự đào thải của phân đoạn SVF khi kết hợp với huyết tương giầu tiểu cầu là một phương pháp an toàn và hiệu quả trong điều trị thoái hóa khớp độ II và III. Hiệu quả của phương pháp được nhìn thấy rõ rệt chỉ sau 6 tháng. Toàn bộ 100% bệnh nhân được thử nghiệm cảm thấy hài lòng với phương pháp này. Cảm giác đau được giảm mạnh chỉ sau 3 tháng. Các lớp sụn dầy hơn sau 6 tháng và chất lượng cuộc sống được cải thiện. Mặc dù cần có những nghiên cứu khác quy mô hơn về số lượng bệnh nhân và các đối tượng điều khiển, nghiên cứu này cũng đã cho thấy, phương pháp của chúng tôi là một hứa hẹn đầy triển vọng trong việc điều trị các bệnh nhân thoái hóa khớp mà ít phải xâm lấn.
Xác nhận
Công trình nghiên cứu được tài trợ bởi GeneWorld Co.,Ltd, Saigon Hi-Tech HCM, VN.
Danh mục viết tắt:
MSCs: Tế bào gốc trung mô
SVF: Phân đoạn tạo mạch
ADSC: Tế bào gốc thu từ mô mỡ
VEGF: Yếu tố tăng trưởng.
PRP: Huyết tương giàu tiểu cầu
PBS: Dung dịch muối đệm phosphat
TGF-β: Yếu tố tăng trưởng– β
EGF: Yếu tố tăng trưởng lớp biểu bì
bFGF: Yếu tố tăng trưởng nguyên bào sợi cơ bản
Lợi ích cạnh tranh
Các tác giả tuyên bố rằng họ không có lợi ích cạnh tranh.
Đóng góp của tác giả
Tất cả các tác giả đọc và phê duyệt bản chính thức. KHTB, TDD, NTN, TDN, VTL, VTM thực hiện phẫu thuật lâm sàng, bao gồm hút mỡ, SVF và tiêm PRP. NLCP, DML cô lập SVF và chuẩn bị PRP. NKP tham gia thiết kế nghiên cứu. PVP chuẩn bị bản thảo trong hợp tác với tất cả các tác giả khác.
Truy cập mở
Bài viết này được cung cấp theo các điều khoản của Creative Com-mons Attribution License (CC-BY 4.0) cho phép việc sử dụng, cun cấp, và tái bản trong bất kỳ môi trường nào, phải đảm bảo cung cấp tác giả ban đầu (s) và các nguồn được ghi.
Tài liệu tham khảo
Amable, P.R., Carias, R.B., Teixeira, M.V., da Cruz Pacheco, I., Correa do Amaral, R.J., Granjeiro, J.M., and Borojevic, R. (2013). Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem cell research & therapy 4, 67.
Banfi, G. (2012). Platelet rich plasma. Journal of biological regulators and homeostatic agents 26, 1.Bendinelli, P., Matteucci, E., Dogliotti, G., Corsi, M.M., Banfi, G., Maroni, P., and Desiderio, M.A. (2010). Molecular basis of anti-inflammatory action of platelet-rich plasma on human chondrocytes: mechanisms of NF-kappaB inhibition via HGF. Journal of cellular physiology 225, 757-766.
Black, L.L., Gaynor, J., Adams, C., Dhupa, S., Sams, A.E., Taylor, R., Harman, S., Gingerich, D.A., and Harman, R. (2008). Effect of intraarticular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Veterinary therapeutics : research in applied veterinary medicine 9, 192-200.
Black, L.L., Gaynor, J., Gahring, D., Adams, C., Aron, D., Harman, S., Gingerich, D.A., and Harman, R. (2007). Effect of adipose-derived mesenchymal stem and regenerative cells on lameness in dogs with chronic osteoarthritis of the coxofemoral joints: a randomized, double-blinded, multicenter, controlled trial. Veterinary therapeutics : research in applied veterinary medicine 8, 272-284.
Chen, L., Ling, P.X., Jin, Y., and Zhang, T.M. (2011). Hyaluronic acid in combination with chondroitin sulfate and hyaluronic acid improved the degeneration of synovium and cartilage equally in rabbits with osteoarthritis. Drug discoveries & therapeutics 5, 190-194.
Christodoulou, I., Kolisis, F.N., Papaevangeliou, D., and Zoumpourlis, V. (2013). Comparative Evaluation of Human Mesenchymal Stem Cells of Fetal (Wharton’s Jelly) and Adult (Adipose Tissue) Origin during Prolonged In Vitro Expansion: Considerations for Cytotherapy. Stem cells international 2013, 246134.
Coudriet, G.M., He, J., Trucco, M., Mars, W.M., and Piganelli, J.D. (2010). Hepatocyte growth factor modulates interleukin-6 production in bone marrow derived macrophages: implications for inflammatory mediated diseases. PloS one 5, e15384.
Dominici, M., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F., Krause, D., Deans, R., Keating, A., Prockop, D., and Horwitz, E. (2006). Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 8, 315-317.
Dougados, M. (2001). The role of anti-inflammatory drugs in the treatment of osteoarthritis: a European viewpoint. Clinical and experimental rheumatology 19, S9-14.
Eyigor, S., Hepguler, S., Sezak, M., Oztop, F., and Capaci, K. (2006).
Effects of intra-articular hyaluronic acid and corticosteroid therapies on articular cartilage in experimental severe osteoarthritis. Clinical and experimental rheumatology 24, 724.
Frisbie, D.D., Bowman, S.M., Colhoun, H.A., DiCarlo, E.F., Kawcak, C.E., and McIlwraith, C.W. (2008). Evaluation of autologous chondrocyte transplantation via a collagen membrane in equine articular defects: results at 12 and 18 months. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society 16, 667-679.
Frisbie, D.D., Kisiday, J.D., Kawcak, C.E., Werpy, N.M., and McIlwraith, C.W. (2009). Evaluation of adipose-derived stromal vascular fraction or bone marrow-derived mesenchymal stem cells for treatment of osteoarthritis. Journal of orthopaedic research : official publication of the Orthopaedic Research Society 27, 1675-1680. Gaiba, S., Franca, L.P., Franca, J.P., and Ferreira, L.M. (2012).
Characterization of human adipose-derived stem cells. Acta cirurgica brasileira / Sociedade Brasileira para Desenvolvimento Pesquisa em Cirurgia 27, 471-476. Gu, J.H., Ji, Y.H., Dhong, E.S., Kim, D.H., and Yoon, E.S. (2012).
Transplantation of adipose derived stem cells for peripheral nerve Bui et al., 201 Biomed Res Ther, 2014 (1):02-08
Symptomatic knee osteoarthritis treatment using autologous adipose derived stem cells 7 regeneration in sciatic nerve defects of the rat. Current stem cell research & therapy 7, 347-355.
Guercio, A., Di Marco, P., Casella, S., Cannella, V., Russotto, L., Purpari, G., Di Bella, S., and Piccione, G. (2012). Production of canine mesenchymal stem cells from adipose tissue and their application in dogs with chronic osteoarthritis of the humeroradial joints. Cell biology international 36, 189-194.
Hamilton, B., Tol, J.L., Knez, W., and Chalabi, H. (2013). Exercise and the platelet activator calcium chloride both influence the growth factor content of platelet-rich plasma (PRP): overlooked biochemical factors that could influence PRP treatment. British journal of sports medicine.
Harn, H.J., Lin, S.Z., Hung, S.H., Subeq, Y.M., Li, Y.S., Syu, W.S., Ding, D.C., Lee, R.P., Hsieh, D.K., Lin, P.C., et al. (2012). Adipose-derived stem cells can abrogate chemical-induced liver fibrosis and facilitate recovery of liver function. Cell transplantation 21, 2753-2764.
Jo, C.H., Lee, Y.G., Shin, W.H., Kim, H., Chai, J.W., Jeong, E.C., Kim, J.E., Shim, H., Shin, J.S., Shin, I.S., et al. (2014). Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: A proof-of-concept clinical trial. Stem cells (Dayton, Ohio).
Karatosun, V., Unver, B., Ozden, A., Ozay, Z., and Gunal, I. (2008). Intra-articular hyaluronic acid compared to exercise therapy in osteoarthritis of the ankle. A prospective randomized trial with long-term follow-up. Clinical and experimental rheumatology 26,288-294.
Khan, W.S., Adesida, A.B., Tew, S.R., Longo, U.G., and Hardingham, T.E. (2012). Fat pad-derived mesenchymal stem cells as a potential source for cell-based adipose tissue repair strategies. Cell proliferation 45, 111-120.
Kilroy, G.E., Foster, S.J., Wu, X., Ruiz, J., Sherwood, S., Heifetz, A., Ludlow, J.W., Stricker, D.M., Potiny, S., Green, P., et al. (2007). Cytokine profile of human adipose-derived stem cells: expression of angiogenic, hematopoietic, and pro-inflammatory factors. Journal of cellular physiology 212, 702-709.
Kreuz, P.C., Gentili, C., Samans, B., Martinelli, D., Kruger, J.P., Mittelmeier, W., Endres, M., Cancedda, R., and Kaps, C. (2013).
Scaffold-assisted cartilage tissue engineering using infant chondrocytes from human hip cartilage. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society 21, 1997-2005.
Lee, C.R., Grodzinsky, A.J., Hsu, H.P., and Spector, M. (2003). Effects of a cultured autologous chondrocyte-seeded type II collagen scaffold on the healing of a chondral defect in a canine model. Journal of orthopaedic research : official publication of the Orthopaedic Research Society 21, 272-281.
Lee, C.S., Burnsed, O.A., Raghuram, V., Kalisvaart, J., Boyan, B.D., and Schwartz, Z. (2012). Adipose stem cells can secrete angiogenic factors that inhibit hyaline cartilage regeneration. Stem cell research & therapy 3, 35.
Lee, J.M., and Im, G.I. (2012). SOX trio-co-transduced adipose stem cells in fibrin gel to enhance cartilage repair and delay the progression of osteoarthritis in the rat. Biomaterials 33, 2016-2024.
Liu, G.B., Cheng, Y.X., Feng, Y.K., Pang, C.J., Li, Q., Wang, Y., Jia, H., and Tong, X.J. (2011). Adipose-derived stem cells promote peripheral nerve repair. Archives of medical science : AMS 7, 592-596.
Mazo, M., Hernandez, S., Gavira, J.J., Abizanda, G., Arana, M., Lopez-Martinez, T., Moreno, C., Merino, J., Martino-Rodriguez, A., Uixeira, A., et al. (2012). Treatment of reperfused ischemia with adipose-derived stem cells in a preclinical Swine model of myocardial infarction. Cell transplantation 21, 2723-2733.
Montaseri, A., Busch, F., Mobasheri, A., Buhrmann, C., Aldinger, C., Rad, J.S., and Shakibaei, M. (2011). IGF-1 and PDGF-bb suppress IL-1beta-induced cartilage degradation through down-regulation of NF-kappaB signaling: involvement of Src/PI-3K/AKT pathway. PloS one 6, e28663.
Murphy, J.M., Fink, D.J., Hunziker, E.B., and Barry, F.P. (2003). Stem cell therapy in a caprine model of osteoarthritis. Arthritis and rheumatism 48, 3464-3474.
Pak, J. (2011). Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of medical case reports 5, 296.
Pecanha, R., Bagno, L.L., Ribeiro, M.B., Robottom Ferreira, A.B., Moraes, M.O., Zapata-Sudo, G., Kasai-Brunswick, T.H., Campos-de-Carvalho, A.C., Goldenberg, R.C., and Saar Werneck-de-Castro, J.P. (2012). Adipose-derived stem-cell treatment of skeletal muscle injury. The Journal of bone and joint surgery American volume 94, 609-617.
Rigol, M., Solanes, N., Farre, J., Roura, S., Roque, M., Berruezo, A., Bellera, N., Novensa, L., Tamborero, D., Prat-Vidal, C., et al. (2010).
Effects of adipose tissue-derived stem cell therapy after myocardial infarction: impact of the route of administration. Journal of cardiac failure 16, 357-366.
Riordan, N.H., Ichim, T.E., Min, W.P., Wang, H., Solano, F., Lara, F., Alfaro, M., Rodriguez, J.P., Harman, R.J., Patel, A.N., et al. (2009).
Non-expanded adipose stromal vascular fraction cell therapy for multiple sclerosis. Journal of translational medicine 7, 29. Salgado, A.J., Reis, R.L., Sousa, N.J., and Gimble, J.M. (2010).
Adipose tissue derived stem cells secretome: soluble factors and their roles in regenerative medicine. Current stem cell research & therapy 5, 103-110.
Santiago, L.Y., Clavijo-Alvarez, J., Brayfield, C., Rubin, J.P., and Marra, K.G. (2009). Delivery of adipose-derived precursor cells for peripheral nerve repair. Cell transplantation 18, 145-158.
Schroeppel, J.P., Crist, J.D., Anderson, H.C., and Wang, J. (2011).
Molecular regulation of articular chondrocyte function and its significance in osteoarthritis. Histology and histopathology 26, 377-394.
Scuderi, N., Ceccarelli, S., Onesti, M.G., Fioramonti, P., Guidi, C., Romano, F., Frati, L., Angeloni, A., and Marchese, C. (2013). Human adipose-derived stromal cells for cell-based therapies in the treatment of systemic sclerosis. Cell transplantation 22, 779-795.
Spakova, T., Rosocha, J., Lacko, M., Harvanova, D., and Gharaibeh, A. (2012). Treatment of Knee Joint Osteoarthritis with Autologous Platelet-Rich Plasma in Comparison with Hyaluronic Acid.
Toghraie, F.S., Chenari, N., Gholipour, M.A., Faghih, Z., Torabinejad, S., Dehghani, S., and Ghaderi, A. (2011). Treatment of Bui et al., 2014 Biomed Res Ther, 2014 (1):02-08
Symptomatic knee osteoarthritis treatment using autologous adipose derived stem cells 8osteoarthritis with infrapatellar fat pad derived mesenchymal stem cells in Rabbit. The Knee 18, 71-75.
van Buul, G.M., Koevoet, W.L., Kops, N., Bos, P.K., Verhaar, J.A., Weinans, H., Bernsen, M.R., and van Osch, G.J. (2011). Platelet-rich plasma releasate inhibits inflammatory processes in osteoarthritic chondrocytes. The American journal of sports medicine 39, 2362-2370.
Van Pham, P., Bui, K.H., Ngo, D.Q., Vu, N.B., Truong, N.H., Phan, N.L., Le, D.M., Duong, T.D., Nguyen, T.D., Le, V.T., et al. (2013a). Activated platelet-rich plasma improves adipose-derived stem cell transplantation efficiency in injured articular cartilage. Stem cell research & therapy 4, 91.
Van Pham, P., Hong-Thien Bui, K., Quoc Ngo, D., Tan Khuat, L., and Kim Phan, N. (2013b). Transplantation of Nonexpanded Adipose Stromal Vascular Fraction and Platelet-Rich Plasma for Articular Cartilage Injury Treatment in Mice Model. Journal of Medical Engineering 2013, 7.
Wieland, H.A., Michaelis, M., Kirschbaum, B.J., and Rudolphi, K.A. (2005). Osteoarthritis – an untreatable disease? Nature reviews Drug discovery 4, 331-344.
Wu, C.C., Chen, W.H., Zao, B., Lai, P.L., Lin, T.C., Lo, H.Y., Shieh, Y.H., Wu, C.H., and Deng, W.P. (2011). Regenerative potentials of platelet-rich plasma enhanced by collagen in retrieving pro-inflammatory cytokine-inhibited chondrogenesis. Biomaterials 32, 5847-5854.
Xiao, J., Zhang, C., Zhang, Y., Zhang, X., Zhao, J., Liang, J., Zhong, X., and Chen, Y. (2012). Transplantation of adipose-derived mesenchymal stem cells into a murine model of passive chronic immune thrombocytopenia. Transfusion 52, 2551-2558.
Yang, J.J., Yang, X., Liu, Z.Q., Hu, S.Y., Du, Z.Y., Feng, L.L., Liu, J.F., and Chen, Y.D. (2012). Transplantation of adipose tissue-derived stem cells overexpressing heme oxygenase-1 improves functions and remodeling of infarcted myocardium in rabbits. The Tohoku journal of experimental medicine 226, 231-241.
Zhu, X., Du, J., and Liu, G. (2012). The comparison of multilineage differentiation of bone marrow and adipose-derived mesenchymal stem cells. Clinical laboratory 58, 897-903.
Zimmerlin, L., Donnenberg, V.S., Rubin, J.P., and Donnenberg, A.D. (2013). Mesenchymal markers on human adipose stem/progenitor cells. Cytometry Part A : the journal of the International Society for Analytical Cytology 83, 134-140.
Zuk, P.A., Zhu, M., Mizuno, H., Huang, J., Futrell, J.W., Katz, A.J., Benhaim, P., Lorenz, H.P., and Hedrick, M.H. (2001). Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue engineering 7, 211-228
Cite this article as:
Bui, K., Duong, T., Nguyen, N., Nguyen, T., Le, V., Mai, V., Phan, N., Le, D., Phan, N., & Pham, P. (2014). Symptomatic knee osteoarthritis treatment using autologous adipose derived stem cells and platelet-rich plasma: a clinical study. Biomedical Research And Therapy, 1(1):2-8.
Biomedical Research and Therapy 2014, 1(2):37-42 ISSN 2198-4093 www.bmrat.org
ORIGINAL RESEARCH
Điều trị thoái hóa khớp gối bằng cách sử dụng tế bào gốc mỡ tự thân và huyết tương giàu tiểu cầu: một nghiên cứu lâm sàng
Khanh Hong-Thien Bui1, Triet Dinh Duong1, Nhan Thanh Nguyen1, Thanh Duc Nguyen1, Vien Tuong Le1, Viet Thanh Mai1, Nhan Lu-Chinh Phan2, Dung Minh Le2, Ngoc Kim Ngoc2, Phuc Van Pham 2,*
1Bệnh viện Đại học y dược Tp. HCM, Thành phố Hồ Chí Minh, Việt Nam
2 PTN nghiên cứu và ứng dụng tế bào gốc, Trường Đại học Khoa học, Đại học Quốc gia Việt Nam, thành phố Hồ Chí Minh, Việt Nam; * Tác giả:pvphuc@hcmuns.edu.vn
Received: 15 December 2013 / Accepted: 02 February 2014 / Published online: 7 February 2014 © The Author(s) 2014. This article is published with open access by BioMedPress (BMP), Laboratory of Stem Cell Research and Application.
TÓM TẮT
Thoái hóa khớp gối là một trong những bệnh phổ biến nhất, và nó ảnh hưởng đến 12 % dân số trên thế giới. Mặc dù căn bệnh này là bệnh mãn tính, nó làm giảm đáng kể chất lượng cuộc sống của bệnh nhân. Hiện nay, liệu pháp tế bào gốc được coi là một cách tiếp cận hiệu quả để điều trị tình trạng này.Tế bào gốc trung mô (MSC) cho thấy tiềm năng nhất cho liệu pháp tế bào gốc điều trị thoái hóa khớp gối. Trong thực tế, MSC có thể phân biệt các mô mesodermal nhất định như sụn và xương. Vì vậy, trong nghiên cứu này, chúng tôi áp dụng MSC có nguồn gốc từ mỡ để điều trị thoái hóa khớp gối. Nghiên cứu này nhằm đánh giá hiệu quả lâm sàng của các mô mỡ tự thân có nguồn gốc MSC cấy ghép ở những bệnh nhân thoái hóa khớp gối độ II và III. Mô mỡ được phân lập từ bụng, và được sử dụng để tách chiết các phân đoạn nhỏ của mạch máu (SVF) . Các SVF được trộn với huyết tương giàu tiểu cầu đã hoạt hóa trước khi tiêm. Hiệu quả lâm sàng được đánh giá bằng điểm đau (VAS), điểm số Lysholm, và MRI. Chúng tôi thực hiện trong 21 trường hợp từ năm 2012-2013. Tất cả 21 bệnh nhân cho thấy cải thiện chức năng khớp sau 8.5 tháng. Điểm số đau giảm từ 7.6 ± 0,5 trước khi tiêm xuống còn 3.5 ± 0,7 sau 3 tháng và 1.5 ± 0.5 sau 6 tháng sau khi tiêm. Điểm số Lysholm tăng từ 61 ± 11 trước khi tiêm lên 82 ± 8.1 sau khi tiêm. Tiến triển đáng kể này đã được ghi nhận trong chụp MRI, với độ dày của lớp sụn tăng.
Hơn nữa, không có tác dụng phụ hoặc biến chứng liên quan đến nhiễm trùng, thải ghép, hoặc tác nhân gây ung thư mới. Những kết quả này cung cấp một cơ hội mới cho việc điều trị thoái hóa khớp gối. Mức chứng cứ : IV.
Keywords-Osteoarthritis, Adipose tissue-derived stem cell, Stromal vascular fraction, Platelet rich plasma.
GIỚI THIỆU
Tổn thương sụn là một tình trạng lâm sàng thường gặp, đặc biệt là ở những người độ tuổi trên 40. Tổn thương như vậy có thể dẫn đến viêm xương khớp nếu không được điều trị thích hợp. Viêm xương khớp là một sự tiến triển thoái hóa mãn tính mà kết quả là thoái hóa sụn khớp, thoái hóa khớp, thay đổi cấu trúc của xương, và mất chức năng khớp (Wieland et al., 2005). Tại thời điểm hiện tại, tổn thương sụn được điều trị bằng thuốc (Dougados năm 2001;. Eyigor et al, 2006) hoặc tiêm axit hyaluronic (Chen et al, 2011;.. Karatosun et al, 2008;. Spakova et al, 2012) để giảm triệu chứng, giảm đau, và kiểm soát vôi hóa. Tuy nhiên, những phương pháp điều trị bị hạn chế về hiệu quả và không ngăn chặn được quá trình tiến triển của bệnh (Schroeppel et al., 2011).
Nuôi cấy sụn cũng được sử dụng để điều trị tổn thương sụn từ năm 1994. Sụn tự thân được tách triết và nuôi cấy trước khi tiêm vào khớp. Nuôi cấy sụn đã cung cấp một số kết quả tốt (Frisbie và cộng sự, 2008;. Kreuz và cộng sự năm 2013,;. Lee et al, 2003.). Tuy nhiên, phương pháp này cũng có một số hạn chế, đặc biệt là thiếu nguồn sụn nuôi cấy, hầu như tất cả các sụn đều bị chết sau một thời gian nuôi cấy trưởng thành.
Một nghiên cứu gần đây cho thấy sự hiện diện của tế bào gốc trong các mô mỡ, và được gọi là các tế bào gốc có nguồn gốc từ các tế bào mỡ (ADSCs). Những tế bào này được coi là tế bào gốc trung mô (MSC) có biểu hiện một số tính chất đặc biệt.
Chúng tham gia hình thành bề mặt giống như nguyên bào sợi, và biệt hóa thành các tế bào tạo xương, sụn, và các tế bào mỡ (Zuk et al. , 2001). Họ cũng thể hiện các dấu hiệu đặc biệt của MSC, chẳng hạn như CD44, CD73, CD90 và CD105, nhưng đều âm tính với CD14, CD34, CD45 (Gaiba et al, 2012; . . Khan và cộng sự, 2012;. Zhu et al, 2012; Zimmerlin và cộng sự, 2013). So với MSC từ tủy xương và máu dây rốn, ADSCs có nhiều lợi thế (Christodoulou et al. , 2013). Đặc biệt, ADSCs là một nguồn tế bào tự thân phù hợp. Cho đến nay, ADSCs đã trở thành ứng cử viên tuyệt vời cho nghiên cứu và ứng dụng lâm sàng. Nhiều nghiên cứu đã chỉ ra rằng cấy ghép ADSC có hiệu quả cải thiện hầu hết các triệu chứng của một số bệnh như xơ gan, dị tật thần kinh (Gu và cộng sự, 2012 ( Harn và cộng sự, 2012. ); . . Liu và cộng sự , 2011 ; Santiago et al, 2009), thiếu máu cục bộ (Mazo et al , 2012 ; . . . . . Rigol và cộng sự, 2010), chấn thương cơ xương (Pecanha và cộng sự, 2012), giảm tiểu cầu miễn dịch thụ động mãn tính (Xiao et al, 2012.), và nhồi máu cơ tim (Yang et al , 2012. ) ở động vật, và xơ cứng mô ở người ( Riordan và cộng sự năm 2009, ; . Scuderi et al , 2013.) .
Với tiềm năng to lớn của ADSCs, nhiều nghiên cứu đã được tiến hành trong vài năm gần đây, bao gồm cả thử nghiệm tiền lâm sàng và thử nghiệm lâm sàng để thực hiện điều trị chấn thương sụn và thoái hóa khớp. Một số mô hình động vật được sử dụng là những chú chó (Black và cộng sự, 2008;.. Black và cộng sự, 2007;. Guercio và cộng sự, 2012) ( Toghraie et al, 2011), trên thỏ, và trên ngựa (Frisbie và cộng sự, 2009) , chuột (Lee và Im, 2012), trên chuột (Ter Huurne và cộng sự năm 2012,;.. Văn Phạm và cộng sự, 2013b), và trên Dê (Murphy et al, 2003.).
Trong một nghiên cứu khác, ngược lại ADSCs được coi là ức chế sụn tái sinh. Kết luận này được rút ra từ thí nghiệm của ADSC ghép ở chuột. Nghiên cứu cho thấy ADSCs highly expressed và tiết ra VEGF-A trên bề mặt môi trường nuôi cấy. Phần nổi đã được tìm thấy để ức chế sự tăng sinh sụn, giảm Sox9, Alcan, và collagen II mức độ mRNA, giảm tổng hợp proteoglycan và tăng quá trình apoptosis. Kiểm tra mô học cho thấy các khuyết tật với ADSCs không mọc vào mô từ các cạnh của khuyết tật (Lee et al., 2012).
Trong các nghiên cứu công bố trước đây, chúng tôi đánh giá invitro trên mô hình động vật (chuột) tác dụng của huyết tương giàu tiểu cầu (PRP) trên ADSC biệt hóa thành tế bào sụn. Invitro, chúng tôi cho thấy điều trị bằng ADSCs kết hợp với PRP thúc đẩy sự phát triển và có sự khác biệt vào các tế bào chondrogenic (Van Pham et al., 2013a). Các tế bào thể hiện collagen II, Sox9, và aggrecan. Kết quả là, ADSCs PRP-pretreated cải thiện điều trị của sụn khớp bị chấn thương trong một mô hình chuột so với không điều trị ADSCs. Trong một nghiên cứu khác, chúng tôi nghiên cứu những tác động của PRP trên SVF ghép trong một mô hình chấn thương sụn chuột, và quan sát thấy sự tái sinh tuyệt vời của sụn (Van Pham et al., 2013b). Hơn nữa, không có tác dụng bất lợi từ ADSC hoặc ghép SVF được ghi lại trong các mô hình động vật (Van Pham et al., 2013a).
Dựa trên những kết quả này, chúng tôi thực hiện thử nghiệm lâm sàng này với mục đích đánh giá hiệu quả và tác dụng phụ của non-expanded SVF kết hợp với PRP trong thoái hóa khớp độ II và III.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Tiêu chí chọn lựa bệnh nhân
Tất cả bệnh nhân tham gia vào nghiên cứu này đều được yêu cầu kí cam kết thử nghiệm lâm sàng. Tất cả các phương pháp được sử dụng trong nghiên cứu này đều được phê duyệt bởi Ban Đạo đức và y tế thuộc Bệnh viện Đại học Y dược Tp Hồ Chí Minh (TP HCM , Vietnam).
Đối với tiêu chí chọn lụa, tất cả bệnh nhân ở độ tuổi trên 18, bị thoái hóa khớp sau trấn thương sụn cấp 2, 3; đã thất bại trong điều trị bằng thuốc cũng như ghép tế bào sụn tự thân, điểm Lysholm thấp hơn 65, đã cam kết với điều kiện phẫu thuật của bệnh viện, âm tính với HIV.
Tổng cộng có 21 bệnh nhân được đưa vào nghiên cứu. Nghiên cứu được thiết kế với phân loại endpoint về tính an toàn và hiệu quả, mô hình can thiệp là phân nhóm duy nhất không có kiểm soát, và mục đích chính là điều trị.
Tách chiết SVF từ mô mỡ
SVF đã được phân lập từ mỡ bụng của mỗi bệnh nhân. Lấy khoảng 50-100 ml mỡ thu thập từ mỗi bệnh nhân được cho vào 2 syringes vô trùng 50 ml. Tất cả các quy trình và các thao tác đã được phê duyệt bởi Ban đạo đức Bệnh viện Đại học Y Dược Thành phố Hồ Chí Minh, Việt Nam. Các syringes được lưu trữ trong một hộp vô trùng và bảo quản ở nhiệt độ 2-8°C và ngay lập tức chuyển đến phòng thí nghiệm.
SVF đã được tách chiết bằng cách sử dụng Bộ kit tách chiết ADSC (GeneWorld Co,. Ltd, Thành phố Hồ Chí Minh, Việt Nam) theo hướng dẫn của nhà sản xuất. Bộ kit này đã được sự cấp phép của Bộ Y tế Việt Nam như là một thiết bị y tế. 50-100 ml mỡ nhanh chóng được chuyển vào trong ống Fancol 250 ml vô trùng, sử dụng một lần (Corning, Tewksbury, MA) và rửa hai lần với PBS vô trùng bằng cách ly tâm 400 × g trong 5 phút ở nhiệt độ phòng. Tiếp theo, các mô mỡ đã được phân hủy bằng cách sử dụng SuperExtract trong bộ kit chứa collagenase ở 37 ° C trong 30 phút trong khoảng thời gian 5 phút. ly tâm ở 800 × g trong 10 phút, và SVF được thu thập ở dạng hạt. Các hạt được rửa sạch hai lần với PBS để loại bỏ bất kỳ enzyme nào còn sót lại, và lơ lửng trong PBS để xác định số lượng tế bào bằng cách sử dụng máy đếm tế bào (NucleoCounter; Chemometec, Đan Mạch ) .
Chuẩn bị PRP hoạt hóa
PRP hoạt hóa được lấy từ máu ngoại vi của bệnh nhân tương tự như xử lí các mô mỡ bằng cách sử dụng bộ kít New-PRPPro Kit (GeneWorld) theo hướng dẫn của nhà sản xuất, thu 20 ml máu ngoại vi được vào ống chân không và ly tâm ở 800 × g trong 10 phút. Lấy phần huyết tương phía trên ống ly tâm và ly tâm lần 2 ở 1000 × g trong 5 phút để thu được các tiểu cầu dạng hạt. Hầu hết các plasma sau đó đã được loại bỏ, giữ lại 3 ml huyết tương cho quá trình tái lắng của tiểu cầu. Cuối cùng, PRP được hoạt hóa bằng cách sử dụng ống hoạt hóa có chứa 100µl 20% CaCl2.
Chuẩn bị các sản phẩm để cấy ghép
Sản phẩm tiêm là một hỗn hợp thu được của SVF và PRP hoạt hóa. PRP hoạt hóa được sử dụng để pha loãng SVF để có một liều thích hợp để tiêm.
Tiêm và theo dõi
Tất cả các bệnh nhân đã được kiểm tra và đánh giá theo tiêu chí thu nhận vào 2 tuần trước khi cấy ghép. Tất cả các bệnh nhân đã được đánh giá lại tại 1, 3, và 6 tháng sau khi cấy ghép. Các phép đo kết quả chính bao gồm chỉ số điểm Lysholm, thay đổi so với ban đầu về điểm số chất lượng cuộc sống , và số lượng các tác dụng phụ được báo cáo (sau 1, 3 và 6 tháng). Các kết quả thứ cấp đã thay đổi so với ban đầu trong X-quang khớp bị ảnh hưởng (số điểm MRI) (sau 6 tháng).
Tất cả các bệnh nhân đã được kiểm tra sau khi hút các mô mỡ và máu ngoại vi để có được SVF và PRP hoạt hóa. Bệnh nhân chờ trong phòng phẫu thuật trong khoảng 2 giờ trước khi nhận được hỗn hợp tiêm của SVF và PRP mà không cần phẫu thuật khớp.
KẾT QUẢ
Nghiên cứu này bắt đầu vào đầu năm 2012 và hoàn thành vào đầu năm 2013. Tất cả bệnh nhân được kiểm tra có thoái hóa khớp ở độ II đến độ III. Kết quả cho thấy những cải tiến đáng kể trong chức năng khớp sau khi 8.5 tháng. Số điểm đau (VAS Walking Index) thay đổi đáng kể và dần dần giảm từ 7.6 ± 0.5 trước khi tiêm còn 3.5 ± 0.7 sau 3 tháng và 1.5 ± 0.5 sau 6 tháng. Điểm số Lysholm cũng được cải thiện đáng kể và dần dần tăng từ 61 ± 11 trước khi tiêm đến 71 ± 13 sau 3 tháng và 82 ± 8.1 sau 6 tháng.

Về mô học, phân tích MRI cho thấy các lớp sụn được tái sinh một phần tại các điểm bị tổn thương. Những hình ảnh MRI cho thấy lớp sụn cũng dày hơn sau 6 tháng điều trị.
Nhìn chung, 100% bệnh nhân hài lòng với kết quả điều trị. Họ cảm thấy mức độ đau đớn của họ giảm dần, đặc biệt là sau 3 tháng. Có 15 bệnh nhân (71,24%) có thể đi lên xuống cầu thang sau 3 tháng. Hiện nay, 100% bệnh nhân có thể đi lại bình thường và thực hiện các hoạt động sống bình thường. Quan trọng hơn, 100% bệnh nhân không có tác dụng phụ hoặc biến chứng liên quan đến quy trình điều trị, chẳng hạn như nhiễm trùng hoặc các yếu tố Tumor khớp.
THẢO LUẬN
Thoái hóa khớp gối là bệnh chấn thương mãn tính phổ biến làm giảm đáng kể chất lượng cuộc sống của bệnh nhân. Trong những năm gần đây, việc ứng dụng ngăn chặn tế bào thoái hóa khớp đã phát triển nhanh hơn, với những kết quả đầy hứa hẹn trong các thử nghiệm tiền lâm sàng và lâm sàng. Nghiên cứu lâm sàng này cho thấy tiêm SVF và PRP mang lại một số kết quả tốt đối với bệnh nhân thoái hóa khớp.
Một trong những kết quả rõ ràng về tác dụng của việc tiêm SVF và PRP là các bệnh nhân cảm thấy giảm đau. Trong thực tế, số điểm VAS đã giảm đáng kể sau 6 tháng (từ 7.6 ± 0,5 đến 1.5 ± 0.5). Giảm đau có liên quan đến vai trò của PRP. Tại thời điểm hiện tại, PRP được sử dụng rộng rãi cho các điều kiện lâm sàng, đặc biệt là trong việc quản lý đau và viêm. PRP đã được báo cáo để ngăn chặn các NFΎB, bằng cách ngăn chặn sự cảm ứng của NFΎB từ IΎB, do đó chặn NFΎB trong tế bào chất và ngăn ngừa cảm ứng của gen mục tiêu NFΎB (van Buul et al., 2011). Trong một nghiên cứu trước đó, người ta thấy rằng NFΎB đã được kích hoạt bởi IL-1Ά trong sụn lấy từ bệnh nhân thoái hóa khớp. Ngay khi NFΎB được kích hoạt, gần như tất cả các con đường đồng hóa gen liên quan, chẳng hạn collagen II và tổng hợp aggrecan, bị chặn. Tuy nhiên, điều trị PRP có thể giải quyết được vấn đề này(van Buul et al, 2011;.. Wu et al, 2011).
Các tác dụng chống viêm và giảm đau cũng có liên quan đến các yếu tố tăng trưởng trong PRP. PRP chứa các cytokine, bao gồm HGF, PDGF, IGF, TGF-Ά, EGF, FGF và (Amable et al, 2013;. Banfi, 2012;. Hamilton et al, 2013). HGF đã được chứng minh hoạt động như một chất ức chế tăng trưởng của NFΎB (Bendinelli et al., 2010), giảm sản xuất các cytokine IL-6, và tăng cytokine chống viêm IL-10 (Coudriet et al., 2010). TGF-Ά1 loại CXCR4 trong bạch cầu đơn nhân (Bendinelli et al, 2010;.. Coudriet et al, 2010). IGF-1 và PDGF cũng ức chế sự hoạt hóa của NFΎB (Montaseri et al., 2011).
Các tác dụng chống viêm và giảm đau cũng đóng góp một phần từ các yếu tố hòa tan tiết ra từ SVF hoặc ADSCs. ADSCs tiết nhiều yếu tố hòa tan quan trọng như HGF, VEGF, NGF, EGF , FGF , và TGF- Ά (Kilroy et al, 2007; . . Salgado et al, 2010 ;. Van Pham et al, 2013a). Không giống như PRP, yếu tố tăng trưởng của ADSCs được sản xuất liên tục sau khi tiêm các tế bào này vào khớp. Tác động thứ hai của việc tiêm SVF và PRP là kích thích tăng trưởng sụn tại các điểm tiêm. Kết quả cho thấy các lớp sụn dần dần trở nên dày hơn từ 3 và 6 tháng sau khi tiêm, và một số điểm sụn bị thương đặc biệt được tái sinh. Những phát hiện này phát sinh từ tác động kết hợp ADSCs và PRP. Trong một số nghiên cứu trước đây của chúng tôi trên chuột, chúng tôi ghi nhận rằng SVF và PRP cũng như ADSC và PRP hoạt hóa hình thành các neocartilage (Van Pham và cộng sự, 2013a ; . . Văn Phạm và cộng sự, 2013b). Như ADSCs thể hiện VEGF- A, nó ức chế sự phát triển của sụn, nếu chỉ ghép ADSCs có thể ức chế sự tăng trưởng sụn (Lee et al. , 2012). Trong nghiên cứu này và một nghiên cứu trước đó trên chuột (Van Pham et al. , 2013a ), chúng tôi sử dụng ADSCs kết hợp với PRP hoạt hóa để ức chế sản xuất VEGF, qua đó cải thiện ADSC biệt hóa thành tế bào sụn.
Sự tồn tại của ADSCs được ghép tại các địa điểm tiêm cũng như sự tham gia của ADSCs trong hình thành neocartilage không được xác minh trong nghiên cứu này. Tuy nhiên, trong một nghiên cứu khác (dữ liệu không hiển thị), chúng tôi đánh dấu ADSCs của người với GFP và tiêm vào các khớp của những con chuột mô hình NOD / SCID. 30 ngày sau khi cấy ghép, các tế bào GFP-đánh dấu ở sụn đầu gối đã được thu thập và đánh giá các biểu hiện của gen nhất định liên quan đến sụn, như collagen loại II, aggrecan, và Sox9. Kết quả cho thấy các tế bào GFP-đánh dấu thể hiện rõ những gen này. Những phát hiện này cho thấy ADSCs trong môi trường khớp gối đã gây ra để biệt hóa thành tế bào sụn.
Các ảnh hưởng có lợi của việc cấy ghép ADSCs cũng đã được ghi nhận trong các thử nghiệm lâm sàng ở một số nước. Trong một nghiên cứu gần đây, Jo et al. (2014) thực hiện một nghiên cứu lâm sàng có liên quan đến điều trị thoái hóa khớp đầu gối bằng cách tiêm ADSCs với 18 bệnh nhân. Sau 6 tháng, bệnh nhân được tiêm 1 × 108 tế bào đã được cải thiện đáng kể điểm số WOMAC và kích thước của sụn khuyết tật, không có tác dụng phụ (Jo et al., 2014). Trong một nghiên cứu liên quan đến ít bệnh nhân hơn , Pak (2011) báo cáo rằng gần như tất cả các bệnh nhân cho thấy sự cải thiện đáng kể trong tất cả các kết quả lâm sàng tại khâu kiểm tra theo dõi cuối cùng. Tất cả các kết quả lâm sàng được cải thiện đáng kể 2 năm tiếp theo so với 12 tháng theo dõi (Pak, 2011).
KẾT LUẬN
Tóm lại, khả năng tự đào thải của phân đoạn SVF khi kết hợp với huyết tương giầu tiểu cầu là một phương pháp an toàn và hiệu quả trong điều trị thoái hóa khớp độ II và III. Hiệu quả của phương pháp được nhìn thấy rõ rệt chỉ sau 6 tháng. Toàn bộ 100% bệnh nhân được thử nghiệm cảm thấy hài lòng với phương pháp này. Cảm giác đau được giảm mạnh chỉ sau 3 tháng. Các lớp sụn dầy hơn sau 6 tháng và chất lượng cuộc sống được cải thiện. Mặc dù cần có những nghiên cứu khác quy mô hơn về số lượng bệnh nhân và các đối tượng điều khiển, nghiên cứu này cũng đã cho thấy, phương pháp của chúng tôi là một hứa hẹn đầy triển vọng trong việc điều trị các bệnh nhân thoái hóa khớp mà ít phải xâm lấn.
Xác nhận
Công trình nghiên cứu được tài trợ bởi GeneWorld Co.,Ltd, Saigon Hi-Tech HCM, VN.
Danh mục viết tắt:
MSCs: Tế bào gốc trung mô
SVF: Phân đoạn tạo mạch
ADSC: Tế bào gốc thu từ mô mỡ
VEGF: Yếu tố tăng trưởng.
PRP: Huyết tương giàu tiểu cầu
PBS: Dung dịch muối đệm phosphat
TGF-β: Yếu tố tăng trưởng– β
EGF: Yếu tố tăng trưởng lớp biểu bì
bFGF: Yếu tố tăng trưởng nguyên bào sợi cơ bản
Lợi ích cạnh tranh
Các tác giả tuyên bố rằng họ không có lợi ích cạnh tranh.
Đóng góp của tác giả
Tất cả các tác giả đọc và phê duyệt bản chính thức. KHTB, TDD, NTN, TDN, VTL, VTM thực hiện phẫu thuật lâm sàng, bao gồm hút mỡ, SVF và tiêm PRP. NLCP, DML cô lập SVF và chuẩn bị PRP. NKP tham gia thiết kế nghiên cứu. PVP chuẩn bị bản thảo trong hợp tác với tất cả các tác giả khác.
Truy cập mở
Bài viết này được cung cấp theo các điều khoản của Creative Com-mons Attribution License (CC-BY 4.0) cho phép việc sử dụng, cun cấp, và tái bản trong bất kỳ môi trường nào, phải đảm bảo cung cấp tác giả ban đầu (s) và các nguồn được ghi.
Tài liệu tham khảo
Amable, P.R., Carias, R.B., Teixeira, M.V., da Cruz Pacheco, I., Correa do Amaral, R.J., Granjeiro, J.M., and Borojevic, R. (2013). Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem cell research & therapy 4, 67.
Banfi, G. (2012). Platelet rich plasma. Journal of biological regulators and homeostatic agents 26, 1.Bendinelli, P., Matteucci, E., Dogliotti, G., Corsi, M.M., Banfi, G., Maroni, P., and Desiderio, M.A. (2010). Molecular basis of anti-inflammatory action of platelet-rich plasma on human chondrocytes: mechanisms of NF-kappaB inhibition via HGF. Journal of cellular physiology 225, 757-766.
Black, L.L., Gaynor, J., Adams, C., Dhupa, S., Sams, A.E., Taylor, R., Harman, S., Gingerich, D.A., and Harman, R. (2008). Effect of intraarticular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Veterinary therapeutics : research in applied veterinary medicine 9, 192-200.
Black, L.L., Gaynor, J., Gahring, D., Adams, C., Aron, D., Harman, S., Gingerich, D.A., and Harman, R. (2007). Effect of adipose-derived mesenchymal stem and regenerative cells on lameness in dogs with chronic osteoarthritis of the coxofemoral joints: a randomized, double-blinded, multicenter, controlled trial. Veterinary therapeutics : research in applied veterinary medicine 8, 272-284.
Chen, L., Ling, P.X., Jin, Y., and Zhang, T.M. (2011). Hyaluronic acid in combination with chondroitin sulfate and hyaluronic acid improved the degeneration of synovium and cartilage equally in rabbits with osteoarthritis. Drug discoveries & therapeutics 5, 190-194.
Christodoulou, I., Kolisis, F.N., Papaevangeliou, D., and Zoumpourlis, V. (2013). Comparative Evaluation of Human Mesenchymal Stem Cells of Fetal (Wharton’s Jelly) and Adult (Adipose Tissue) Origin during Prolonged In Vitro Expansion: Considerations for Cytotherapy. Stem cells international 2013, 246134.
Coudriet, G.M., He, J., Trucco, M., Mars, W.M., and Piganelli, J.D. (2010). Hepatocyte growth factor modulates interleukin-6 production in bone marrow derived macrophages: implications for inflammatory mediated diseases. PloS one 5, e15384.
Dominici, M., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F., Krause, D., Deans, R., Keating, A., Prockop, D., and Horwitz, E. (2006). Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 8, 315-317.
Dougados, M. (2001). The role of anti-inflammatory drugs in the treatment of osteoarthritis: a European viewpoint. Clinical and experimental rheumatology 19, S9-14.
Eyigor, S., Hepguler, S., Sezak, M., Oztop, F., and Capaci, K. (2006).
Effects of intra-articular hyaluronic acid and corticosteroid therapies on articular cartilage in experimental severe osteoarthritis. Clinical and experimental rheumatology 24, 724.
Frisbie, D.D., Bowman, S.M., Colhoun, H.A., DiCarlo, E.F., Kawcak, C.E., and McIlwraith, C.W. (2008). Evaluation of autologous chondrocyte transplantation via a collagen membrane in equine articular defects: results at 12 and 18 months. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society 16, 667-679.
Frisbie, D.D., Kisiday, J.D., Kawcak, C.E., Werpy, N.M., and McIlwraith, C.W. (2009). Evaluation of adipose-derived stromal vascular fraction or bone marrow-derived mesenchymal stem cells for treatment of osteoarthritis. Journal of orthopaedic research : official publication of the Orthopaedic Research Society 27, 1675-1680. Gaiba, S., Franca, L.P., Franca, J.P., and Ferreira, L.M. (2012).
Characterization of human adipose-derived stem cells. Acta cirurgica brasileira / Sociedade Brasileira para Desenvolvimento Pesquisa em Cirurgia 27, 471-476. Gu, J.H., Ji, Y.H., Dhong, E.S., Kim, D.H., and Yoon, E.S. (2012).
Transplantation of adipose derived stem cells for peripheral nerve Bui et al., 201 Biomed Res Ther, 2014 (1):02-08
Symptomatic knee osteoarthritis treatment using autologous adipose derived stem cells 7 regeneration in sciatic nerve defects of the rat. Current stem cell research & therapy 7, 347-355.
Guercio, A., Di Marco, P., Casella, S., Cannella, V., Russotto, L., Purpari, G., Di Bella, S., and Piccione, G. (2012). Production of canine mesenchymal stem cells from adipose tissue and their application in dogs with chronic osteoarthritis of the humeroradial joints. Cell biology international 36, 189-194.
Hamilton, B., Tol, J.L., Knez, W., and Chalabi, H. (2013). Exercise and the platelet activator calcium chloride both influence the growth factor content of platelet-rich plasma (PRP): overlooked biochemical factors that could influence PRP treatment. British journal of sports medicine.
Harn, H.J., Lin, S.Z., Hung, S.H., Subeq, Y.M., Li, Y.S., Syu, W.S., Ding, D.C., Lee, R.P., Hsieh, D.K., Lin, P.C., et al. (2012). Adipose-derived stem cells can abrogate chemical-induced liver fibrosis and facilitate recovery of liver function. Cell transplantation 21, 2753-2764.
Jo, C.H., Lee, Y.G., Shin, W.H., Kim, H., Chai, J.W., Jeong, E.C., Kim, J.E., Shim, H., Shin, J.S., Shin, I.S., et al. (2014). Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: A proof-of-concept clinical trial. Stem cells (Dayton, Ohio).
Karatosun, V., Unver, B., Ozden, A., Ozay, Z., and Gunal, I. (2008). Intra-articular hyaluronic acid compared to exercise therapy in osteoarthritis of the ankle. A prospective randomized trial with long-term follow-up. Clinical and experimental rheumatology 26,288-294.
Khan, W.S., Adesida, A.B., Tew, S.R., Longo, U.G., and Hardingham, T.E. (2012). Fat pad-derived mesenchymal stem cells as a potential source for cell-based adipose tissue repair strategies. Cell proliferation 45, 111-120.
Kilroy, G.E., Foster, S.J., Wu, X., Ruiz, J., Sherwood, S., Heifetz, A., Ludlow, J.W., Stricker, D.M., Potiny, S., Green, P., et al. (2007). Cytokine profile of human adipose-derived stem cells: expression of angiogenic, hematopoietic, and pro-inflammatory factors. Journal of cellular physiology 212, 702-709.
Kreuz, P.C., Gentili, C., Samans, B., Martinelli, D., Kruger, J.P., Mittelmeier, W., Endres, M., Cancedda, R., and Kaps, C. (2013).
Scaffold-assisted cartilage tissue engineering using infant chondrocytes from human hip cartilage. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society 21, 1997-2005.
Lee, C.R., Grodzinsky, A.J., Hsu, H.P., and Spector, M. (2003). Effects of a cultured autologous chondrocyte-seeded type II collagen scaffold on the healing of a chondral defect in a canine model. Journal of orthopaedic research : official publication of the Orthopaedic Research Society 21, 272-281.
Lee, C.S., Burnsed, O.A., Raghuram, V., Kalisvaart, J., Boyan, B.D., and Schwartz, Z. (2012). Adipose stem cells can secrete angiogenic factors that inhibit hyaline cartilage regeneration. Stem cell research & therapy 3, 35.
Lee, J.M., and Im, G.I. (2012). SOX trio-co-transduced adipose stem cells in fibrin gel to enhance cartilage repair and delay the progression of osteoarthritis in the rat. Biomaterials 33, 2016-2024.
Liu, G.B., Cheng, Y.X., Feng, Y.K., Pang, C.J., Li, Q., Wang, Y., Jia, H., and Tong, X.J. (2011). Adipose-derived stem cells promote peripheral nerve repair. Archives of medical science : AMS 7, 592-596.
Mazo, M., Hernandez, S., Gavira, J.J., Abizanda, G., Arana, M., Lopez-Martinez, T., Moreno, C., Merino, J., Martino-Rodriguez, A., Uixeira, A., et al. (2012). Treatment of reperfused ischemia with adipose-derived stem cells in a preclinical Swine model of myocardial infarction. Cell transplantation 21, 2723-2733.
Montaseri, A., Busch, F., Mobasheri, A., Buhrmann, C., Aldinger, C., Rad, J.S., and Shakibaei, M. (2011). IGF-1 and PDGF-bb suppress IL-1beta-induced cartilage degradation through down-regulation of NF-kappaB signaling: involvement of Src/PI-3K/AKT pathway. PloS one 6, e28663.
Murphy, J.M., Fink, D.J., Hunziker, E.B., and Barry, F.P. (2003). Stem cell therapy in a caprine model of osteoarthritis. Arthritis and rheumatism 48, 3464-3474.
Pak, J. (2011). Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of medical case reports 5, 296.
Pecanha, R., Bagno, L.L., Ribeiro, M.B., Robottom Ferreira, A.B., Moraes, M.O., Zapata-Sudo, G., Kasai-Brunswick, T.H., Campos-de-Carvalho, A.C., Goldenberg, R.C., and Saar Werneck-de-Castro, J.P. (2012). Adipose-derived stem-cell treatment of skeletal muscle injury. The Journal of bone and joint surgery American volume 94, 609-617.
Rigol, M., Solanes, N., Farre, J., Roura, S., Roque, M., Berruezo, A., Bellera, N., Novensa, L., Tamborero, D., Prat-Vidal, C., et al. (2010).
Effects of adipose tissue-derived stem cell therapy after myocardial infarction: impact of the route of administration. Journal of cardiac failure 16, 357-366.
Riordan, N.H., Ichim, T.E., Min, W.P., Wang, H., Solano, F., Lara, F., Alfaro, M., Rodriguez, J.P., Harman, R.J., Patel, A.N., et al. (2009).
Non-expanded adipose stromal vascular fraction cell therapy for multiple sclerosis. Journal of translational medicine 7, 29. Salgado, A.J., Reis, R.L., Sousa, N.J., and Gimble, J.M. (2010).
Adipose tissue derived stem cells secretome: soluble factors and their roles in regenerative medicine. Current stem cell research & therapy 5, 103-110.
Santiago, L.Y., Clavijo-Alvarez, J., Brayfield, C., Rubin, J.P., and Marra, K.G. (2009). Delivery of adipose-derived precursor cells for peripheral nerve repair. Cell transplantation 18, 145-158.
Schroeppel, J.P., Crist, J.D., Anderson, H.C., and Wang, J. (2011).
Molecular regulation of articular chondrocyte function and its significance in osteoarthritis. Histology and histopathology 26, 377-394.
Scuderi, N., Ceccarelli, S., Onesti, M.G., Fioramonti, P., Guidi, C., Romano, F., Frati, L., Angeloni, A., and Marchese, C. (2013). Human adipose-derived stromal cells for cell-based therapies in the treatment of systemic sclerosis. Cell transplantation 22, 779-795.
Spakova, T., Rosocha, J., Lacko, M., Harvanova, D., and Gharaibeh, A. (2012). Treatment of Knee Joint Osteoarthritis with Autologous Platelet-Rich Plasma in Comparison with Hyaluronic Acid.
Toghraie, F.S., Chenari, N., Gholipour, M.A., Faghih, Z., Torabinejad, S., Dehghani, S., and Ghaderi, A. (2011). Treatment of Bui et al., 2014 Biomed Res Ther, 2014 (1):02-08
Symptomatic knee osteoarthritis treatment using autologous adipose derived stem cells 8osteoarthritis with infrapatellar fat pad derived mesenchymal stem cells in Rabbit. The Knee 18, 71-75.
van Buul, G.M., Koevoet, W.L., Kops, N., Bos, P.K., Verhaar, J.A., Weinans, H., Bernsen, M.R., and van Osch, G.J. (2011). Platelet-rich plasma releasate inhibits inflammatory processes in osteoarthritic chondrocytes. The American journal of sports medicine 39, 2362-2370.
Van Pham, P., Bui, K.H., Ngo, D.Q., Vu, N.B., Truong, N.H., Phan, N.L., Le, D.M., Duong, T.D., Nguyen, T.D., Le, V.T., et al. (2013a). Activated platelet-rich plasma improves adipose-derived stem cell transplantation efficiency in injured articular cartilage. Stem cell research & therapy 4, 91.
Van Pham, P., Hong-Thien Bui, K., Quoc Ngo, D., Tan Khuat, L., and Kim Phan, N. (2013b). Transplantation of Nonexpanded Adipose Stromal Vascular Fraction and Platelet-Rich Plasma for Articular Cartilage Injury Treatment in Mice Model. Journal of Medical Engineering 2013, 7.
Wieland, H.A., Michaelis, M., Kirschbaum, B.J., and Rudolphi, K.A. (2005). Osteoarthritis – an untreatable disease? Nature reviews Drug discovery 4, 331-344.
Wu, C.C., Chen, W.H., Zao, B., Lai, P.L., Lin, T.C., Lo, H.Y., Shieh, Y.H., Wu, C.H., and Deng, W.P. (2011). Regenerative potentials of platelet-rich plasma enhanced by collagen in retrieving pro-inflammatory cytokine-inhibited chondrogenesis. Biomaterials 32, 5847-5854.
Xiao, J., Zhang, C., Zhang, Y., Zhang, X., Zhao, J., Liang, J., Zhong, X., and Chen, Y. (2012). Transplantation of adipose-derived mesenchymal stem cells into a murine model of passive chronic immune thrombocytopenia. Transfusion 52, 2551-2558.
Yang, J.J., Yang, X., Liu, Z.Q., Hu, S.Y., Du, Z.Y., Feng, L.L., Liu, J.F., and Chen, Y.D. (2012). Transplantation of adipose tissue-derived stem cells overexpressing heme oxygenase-1 improves functions and remodeling of infarcted myocardium in rabbits. The Tohoku journal of experimental medicine 226, 231-241.
Zhu, X., Du, J., and Liu, G. (2012). The comparison of multilineage differentiation of bone marrow and adipose-derived mesenchymal stem cells. Clinical laboratory 58, 897-903.
Zimmerlin, L., Donnenberg, V.S., Rubin, J.P., and Donnenberg, A.D. (2013). Mesenchymal markers on human adipose stem/progenitor cells. Cytometry Part A : the journal of the International Society for Analytical Cytology 83, 134-140.
Zuk, P.A., Zhu, M., Mizuno, H., Huang, J., Futrell, J.W., Katz, A.J., Benhaim, P., Lorenz, H.P., and Hedrick, M.H. (2001). Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue engineering 7, 211-228
Cite this article as:
Bui, K., Duong, T., Nguyen, N., Nguyen, T., Le, V., Mai, V., Phan, N., Le, D., Phan, N., & Pham, P. (2014). Symptomatic knee osteoarthritis treatment using autologous adipose derived stem cells and platelet-rich plasma: a clinical study. Biomedical Research And Therapy, 1(1):2-8.


